|
Source: Cannabis Health Journal カナビスの主要な活性成分であるΔ9-THCや他の様々なカナビノイドは、ほとんどが体内のカナビノイド・レセプターと結び付くことによって効果が現れる。治療効果が期待されるカナビノイドとしては、THCの他にも、カナビジオール(CBD)とTHCの体内代謝物であるカルボシルΔ9-THC(THC-COOH)やその派生物などがあるが、その全容はまだ十分には解明されていない。 THCの効果の大半は、カナビノイド・レセプターに対してアゴニストとして働くことで生み出される。アゴニストというのはレセプターに何らかの反応を起こさせて活性化させる物質を意味する (これに対してレセプターを遮断して無反応にしてまう物質をアンタゴニストという)。カナビノイド・レセプターが活性化すると、脳の痛みを感知する中心に作用して痛みを和らげるが、その作用状態はレセプター表面の細胞の位置によって異なっている。 免疫システムに対する効果や神経防護作用、制吐作用などに関しては、カナビノイド・レセプターではない一部のレセプターでも、THCやその合成派生物の効果に介在していることも知られている。以前ではレセプターを介さないカナビノイド効果もあると考えられていたが、未知のカナビノイド・レセプター亜種(サブタイプ)が存在している可能性もある。 カナビノイド・レセプター 現在までのところ、カナビノイド・レセプターとしてはCB1とCB2の2種類が見付かっているが、信号の処理メカニズム、臓器や細胞組織での分布状態、アナゴニストやアンタゴニストに対する感度が異なっている。 CB1レセプターは、主に脳内の神経細胞や脊髄周辺の神経システムに存在している。しかし数は少ないものの、内分泌腺や白血球、脾臓、心臓、生殖器、尿器官、消化管などの周辺臓器や細胞組織にも見られる。CB1レセプターの働きの一つは神経伝達物質の放出を抑制する機能で、脳内での生成を抑える。この働きは、カナビノイド・システムの中でも最も重要なものの一つにあげられる。 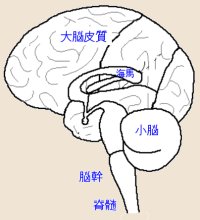 CB1レセプターは、大脳皮質、小脳、海馬、さらに脊髄に特定部位に特に集中しているが、このことは運動機能(大脳皮質、小脳)、記憶処理(海馬)、痛みの調整(脊髄)にとって、カナビノイド・システムが重要な役割を果たしていることを反映している。一方、脳幹におけるCB1レセプターの集中度合いは低く、カナビスが呼吸不全による急性致死を起こさない理由と考えられている。脳幹は脳と脊髄を結びつけ、脈拍や血圧や呼吸などをコントロールして生命維持機能全般に関係している。
CB1レセプターは、大脳皮質、小脳、海馬、さらに脊髄に特定部位に特に集中しているが、このことは運動機能(大脳皮質、小脳)、記憶処理(海馬)、痛みの調整(脊髄)にとって、カナビノイド・システムが重要な役割を果たしていることを反映している。一方、脳幹におけるCB1レセプターの集中度合いは低く、カナビスが呼吸不全による急性致死を起こさない理由と考えられている。脳幹は脳と脊髄を結びつけ、脈拍や血圧や呼吸などをコントロールして生命維持機能全般に関係している。CB2レセプターは主に、白血球や脾臓や扁桃腺などの免疫細胞に見られる。CB1レセプターも同じ免疫細胞内に存在しているが数は少ない。 CB1レセプターは精神や血液循環に対してカナビスに似た酩酊作用を引き起こすが、CB2レセプターにはこのような機能はなく、このことが酩酊作用を持たないカナビノイドの抗炎症剤や制ガン剤など開発にあたって、CB2レセプターに選択的に働くアゴニストを探そうとする機運の高まりとなって表れている。 脳やその周辺では、カナビノイド・レセプターとして亜種の存在を示す証拠が増えてきているが、構造が多少違っているだけで機能的にはCB1やCB2レセプターとほぼ同じに過ぎない。現在までのところ、人間のゲノムの中にそれ以外のカナビノイド・レセプターが存在するという証拠はない。 エンドカナビノイド カナビノイド・レセプターが発見されると、動物や人間の体内でそのレスプターに作用する物質の探索が始まった。見つかった物質は脂肪酸の派生物で、総称してエンドカナビノイド(内因性カナビノイド)と呼ばれている。現在までのところエンドカナビノイドとしては、アナンダミド(AEA)、2-AG、ノルダイン・エーテル、ビロドハマイン、NADA、の5種類が見つかっている。最初に発見されたアナンダミドはサンスクリッド語のアーナンダ(恩恵)と脂肪酸をあらわすアミドから名付けられた。 カナビノイド・レセプターとエンドカナビノイドは一体となってカナビノイド・システムを構成し、エンドカナビノイドは神経伝達物質や神経調整物質の一種として働いている。このシステムは何千万年もの昔から存在していたもので、哺乳類をはじめ多くの動物種に見つかっている。 アナンダミドとNADAはカナビノイド・レセプターと結合して働くばかりではなく、痛覚に関連した非選択的なイオン・チャンネルであるバニロイド・レセプター(VR1)も刺激する。ホット・チリペッパーの成分として知られるカプサイシンもバニロイド・レセプターを活性化するが、このために当初、エンドカナビノイドとしてのアナンダミドはそうしたものの一種だと考えられ、カナビノイド・レセプターは単にアナンダミド専用のレセプターとして見られていた。 アナンダミドとその次に発見された2-AGについては多数の研究が行われている。エンドカナビノイドはあらかじめ生成されて貯蔵されているのではなく、刺激量に比例してオンデマンドで生成され細胞から放出される。刺激の一つとしては痛覚があり、痛みをコントロールしている脳の部分でエンドカナビノイドのレベルが増加する。その他の刺激としては空腹があり、食欲をコントロールしている消化器や脳でエンドカナビノイドの濃度を高める。 エンドカナビノイドはカナビノイド・レセプターの存在する組織内で生成され放出される。放出されると即座に細胞に取り込まれて、活性を失い代謝されてしまう。THCの効果は数時間持続するが、それに比較するとカナビノイドの作用時間はせいぜい数分に過ぎない。 カナビノイド・レセプターに対するカナビノイドの親和性 カナビノイドのカナビス・レセプターに対する親和性はCB1レセプターとCB2レセプターでは異なっている。合成カナビノイドに関しては、それぞれのレセプターに対して、極めて選択的にアゴニストあるいはアンタゴニストとして働くものが開発されている。 カナビスの成分であるΔ9-THCはどちらのレセプターに対しても同等の親和性を持っているが、アナンダミドの場合はCB1レセプターより大きな選択性を備えている。しかしながら、THCもアナンダミドも、CB2レセプターに対してはCB1レセプターよりも影響力は弱い。 エンドカナビノイド・システムの活性持続性 カナビノイド・レセプターに蓋をして活性を奪ってしまうアンタゴニストを投与すると、エンドカナビノイドの効果が阻害されるばかりではなく、アゴニストの拡散方向を逆にして送り返して、痛みが増すという現象が現れる。このことは、通常、エンドカナビノイドが定常的に放出されているか、または、カナビノイド・レセプターに一部が構造的に常にアクティブになっていることを示唆しており、カナビノイド・システムが持続的にアクティブな状態になっていることを意味している。 いくつかの条件下において、実際にカナビノイド・システムに持続性があることが明らかにされている。例えば,脳の痛みの回路(中脳水道周囲灰白質)が痛みの刺激を受けるとエンドカナビノイドのレベルが持続的に上昇することがわかっている。その他では、多発性硬化症に動物実験モデルにつかう長期再発型の自己免疫性脳脊髄炎(CREAE)マウスでは、エンドカナビノイドによって痙縮が持続的に抑制される。 長期神経因性疼痛のラット・モデルや腸管炎症のマウス・モデルでは、神経が損傷された後でカナビノイド・レセプターが増加することが知られている。このことは、神経損傷の治療にカナビノイドを使えば、レセプター数の増加で効力が強まる可能性があることを示唆している。また、カナビノイド・システムの持続性は、脳の嘔吐回路において食欲や吐き気が制御されることでも示されている。 アンタゴニスト(ブロッカー) アンタゴニストは、エンドカナビノイドの生理的機能を妨害するように働く。そのメカニズムについてはいくつかのモデルが提案されているが、その中には、アンタゴニストがエンドカナビノイドを中和してしまう、あるいは常時アクティブになっているカナビノイド・レセプターを変調して不活性な状態にする、あるいはカナビノイド・レセプターとは独立して働く、といったものがある。 アンタゴニストは、運動活性を増加させたり、記憶を改善したり、痛みに対する感度を上げたり、吐き気を起こすなどといった作用が動物実験で報告されている。 また、エンドカナビノイドは、身体や精神に対する暴力といったトラウマや嫌な記憶を脳から消し去るのに重要な役割を果たしているが、アンタゴニストはそうした能力をブロックして、いつまでも記憶が残るように作用することも知られている。 治療薬への期待 カナビノイドがカナビノイド・レセプターを活性化したり相互作用したりするメカニズムは、エンドカナビノイドの濃度や抗酸化作用に影響を与えたり、他の化合物と相互作用して代謝したりして相当複雑で入り組んでいるが、カナビノイドには、エンドカナビノイドの作用を高めて、食欲増進や、痛みの軽減、筋肉の緊張緩和、眼圧の低下、気分転換などの作用がある。 CBレセプターをブロックするアンタゴニストは、肥満やニコチン中毒の治療薬として研究が行われている。また、THCやCBDに伴う精神活性作用を切り離して目的の治療効果だけを取り出すことを目指して、CB1レセプターとは連結しない合成カナビノイド派生物の臨床研究も盛んに実施されている。 そうしたものとしては、血液脳関門を突破してカナビノイド・レセプターと連結しないCB1レセプター・アゴニストの研究や、細胞内膜輸送を抑制したり、脂肪酸アミドの加水分解(FAAH)を抑制したりして、エンドカナビノイド・レベルに影響を与えて効力を高める化合物の開発が進められている。例えば、アナンダミドの代謝を遅らせるブロッカーは、動物実験で不安をやわらげることが知られている。 FAAHの抑制剤の開発は目ざましく、すでに臨床研究も行われている。非ステロイド系の抗炎症剤フルルビプロフェンは、脊髄の髄液の投与することでFAAHを抑制し、エンドカナビノイドのレベルを上昇させて炎症の痛みを緩和する働きが確かめられている。 参考文献 Grotenhermen F: Clinical Pharmacodynamics of Cannabinoids. J Cannabis Ther 2004;4(1):29-78. Grotenhermen F: Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokin 2003;42(4):327-360. Grotenhermen F: Cannabinoids and the Endocannabinoid System Cannabinoids 2006;1(1):10-14, 17 Sep, 2006 |





医学博士。ドイツ・ケルンのノバ研究所所属。国際カナビス医薬品学会(IACM)執行委員長。